山東國際注冊eCTD哪家好
ANDA一般不需要提供臨床前(動物)和臨床(人體)數(shù)據(jù)來證明其安全性和有效性(即免毒理和臨床),作為替代,申請人必須合理證明其產(chǎn)品與原研藥相比是生物等效的。 按照《聯(lián)邦食品、藥品和化妝品法》第 505(j)章要求,擬向FDA遞交申請ANDA的藥品需符合以下條件: 仿制藥必須依照FDA《經(jīng)過醫(yī)療等同性評價批準(zhǔn)的藥品》(俗稱"橙皮書")上所列,由FDA選定的RLD/RS進行對照仿制; 活性成份、劑型、規(guī)格、給藥途徑、適應(yīng)癥,要與RLD相同; 仿制藥必須證明與RLD在生物效果上等同,即具有生物等效性; 必須按照美國聯(lián)邦管理法21 CFR遵行藥品生產(chǎn)管理規(guī)范控制生產(chǎn)過程; 無論中國還是美國,要求仿制藥的質(zhì)量必須等同或者是高于參比制劑的,這是獲批的基本要點; 注意:如果原研藥未被列為RLD,申請人可以提出公民,向FDA申請。美國NDA注冊申報相關(guān)技術(shù)支持。山東國際注冊eCTD哪家好

設(shè)施費動態(tài)調(diào)整 API工廠和制劑工廠年費分別約6.8萬和14.5萬美元(2025財年),CMO工廠費用為制劑費的24%。國外工廠需額外支付1.5萬美元跨境檢查費。 ?繳費時限與懲罰 費用需在財年首日(10月1日)起20天內(nèi)繳納,逾期將列入拖欠名單并暫停ANDA受理,涉事藥品視為冒牌產(chǎn)品。 ?豁免與特殊情形 PET藥物、非商業(yè)產(chǎn)品及停產(chǎn)超一年的工廠可豁免繳費。已繳費工廠若年度內(nèi)無生產(chǎn)活動,仍需繳納費用。 ?行業(yè)影響與策略 費用上漲推動企業(yè)優(yōu)化申報策略,例如集中ANDA提交周期、采用CMO外包降低設(shè)施費,并通過預(yù)認(rèn)證(如DMF完整性評估)減少重復(fù)支出。 工業(yè)園區(qū)國內(nèi)注冊eCTD注冊系統(tǒng)加拿大eCTD申報相關(guān)技術(shù)支持。
中國將進一步與國際接軌,推進eCTD等標(biāo)準(zhǔn)應(yīng)用,提高藥品注冊效率和質(zhì)量。AI技術(shù)可能在藥品注冊領(lǐng)域廣泛應(yīng)用,如輔助審評人員工作。未來藥品注冊資料將更注重結(jié)構(gòu)化數(shù)據(jù),有助于監(jiān)管機構(gòu)高效獲取和利用數(shù)據(jù)。 eCTD等數(shù)字化工具將推動藥品監(jiān)管向智慧監(jiān)管和全生命周期監(jiān)管發(fā)展,提高監(jiān)管效率和質(zhì)量。區(qū)塊鏈技術(shù)具有應(yīng)用前景,可構(gòu)建全球統(tǒng)一的藥品申報數(shù)據(jù)平臺。數(shù)據(jù)化時代,藥品注冊領(lǐng)域?qū)⒏⒅財?shù)據(jù)收集、分析和利用,為監(jiān)管機構(gòu)和企業(yè)提供決策支持。 總而言之,展望未來,隨著eCTD在藥品注冊領(lǐng)域的廣泛應(yīng)用和不斷發(fā)展,中國將逐步建立起與國際接軌的藥品注冊體系。這將有助于提高中國藥品注冊的效率和質(zhì)量,推動中國藥品走向世界舞臺。同時,企業(yè)也需要密切關(guān)注技術(shù)發(fā)展動態(tài)和監(jiān)管政策變化,及時調(diào)整自身戰(zhàn)略和規(guī)劃,以適應(yīng)未來的市場競爭和監(jiān)管要求。
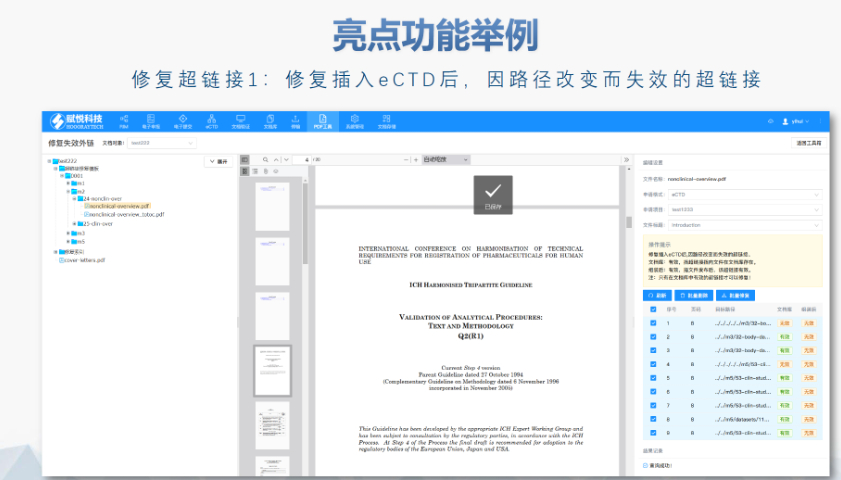
賦悅eCTD系統(tǒng) ?文件驗證與修復(fù) 支持自動驗證文件格式(如PDF屬性、字體嵌入、超鏈接完整性等),并一鍵修復(fù)不符合法規(guī)要求的文件。例如,系統(tǒng)會自動檢查XML主干文件的結(jié)構(gòu)合規(guī)性,確保符合中國、美國、歐盟等地區(qū)的eCTD法規(guī)標(biāo)準(zhǔn)。 ?eCTD組裝與發(fā)布 可自動生成符合CTD結(jié)構(gòu)的電子文檔包,包括XML主干文件、文件夾命名規(guī)范及序列號管理(如申請?zhí)?序列號文件夾自動生成),并支持超鏈接和書簽的批量創(chuàng)建。例如,初次提交的序列號為0000,后續(xù)每次提交自動遞增。 ?生命周期管理 支持文件全生命周期操作(增、增補、替換、刪除),并通過序列號疊加直觀顯示各章節(jié)文件的有效性,覆蓋從初次提交到年報、撤市的全流程管理。 ?協(xié)同與權(quán)限管理 基于B/S架構(gòu)(瀏覽器/服務(wù)器),支持云端或本地靈活部署,全集團賬號通用。提供多用戶協(xié)作功能,包括權(quán)限分級、審計追蹤、文件版本控制等。 ?法規(guī)支持與專業(yè)服務(wù) 內(nèi)置符合中國CDE、美國FDA、歐盟EMA等法規(guī)的模板,同時提供注冊咨詢、資料撰寫、eCTD格式代轉(zhuǎn)等全流程支持,團隊擁有17年藥品注冊經(jīng)驗。美國eCTD注冊咨詢相關(guān)技術(shù)支持。
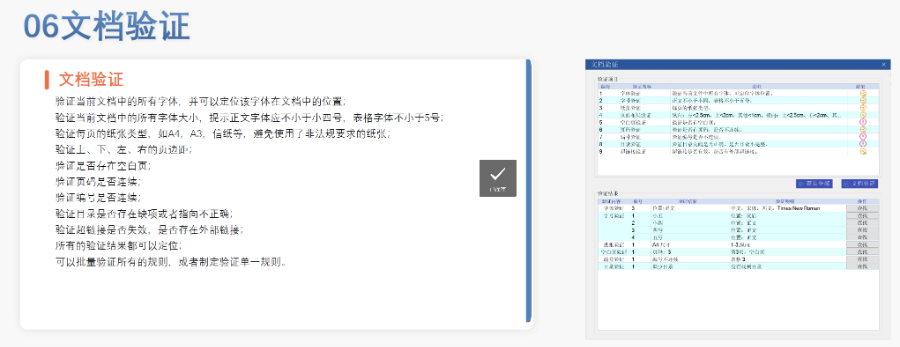
eCTD文件制作需遵循嚴(yán)格的法規(guī)要求和標(biāo)準(zhǔn)化流程,以下是關(guān)鍵要點整理:eCTD采用模塊化結(jié)構(gòu),包含模塊1(行政信息)至模塊5(臨床報告),需按ICH和監(jiān)機構(gòu)要求構(gòu)建目錄樹。顆粒度選擇:文件提交層級需在***申報時確定并沿用,例如原料和制劑的章節(jié)(如、)需按比較低顆粒度拆分,輔料單獨成章。PDF需添加書簽(導(dǎo)航目錄)和超鏈接(跨網(wǎng)頁跳轉(zhuǎn)),超過5頁的文件必須包含目錄(TOC/LOT/LOF)。技術(shù)參數(shù):初始視圖需設(shè)置默認(rèn)縮放級別和頁面布局,書簽展開層級不超過三級,單文件大小需符合申報系統(tǒng)限制。驗證工具:使用軟件(如BXeCTD)自動生成書簽和超鏈接,并通過序列校驗和PDF校驗功能確保合規(guī)性。 美國注冊鄧白氏號申請相關(guān)技術(shù)支持。南京新藥eCTD常用解決方案
加拿大ANDA注冊申報相關(guān)技術(shù)支持。山東國際注冊eCTD哪家好
賦悅Word插件 自主研發(fā)Word插件 快速編輯:整合word常用功能按鈕,避免頻繁切換菜單;內(nèi)置標(biāo)題、段落、文字、目錄、超鏈接等的格式和樣式,可快速設(shè)置和更文檔的格式 快速鏈接:雙擊或者拖拽的方式,制作文本超鏈接或者題注超鏈接;可搜索全文關(guān)鍵字,自動制作超鏈接 文檔拆分:可根據(jù)不同的條件將word文件顆粒化,如分節(jié)符、頁眉、頁腳、頁碼范圍和自定義頁碼等 PDF轉(zhuǎn)換:WORD轉(zhuǎn)PDF,自動判斷是否生成書簽,自動鑲嵌所有字體,生成PDF快速網(wǎng)頁瀏覽的PDF,確保生成的PDF所有屬性符合法規(guī)要求 文檔驗證:驗證文檔的字體、字號、紙張、頁面布局、空白頁、頁碼、編號、目錄、超鏈接等,并且可以定位驗證結(jié)果 可定制:可根據(jù)用戶需求定制格式和樣式模板山東國際注冊eCTD哪家好
賦悅科技(杭州)有限責(zé)任公司在同行業(yè)領(lǐng)域中,一直處在一個不斷銳意進取,不斷制造創(chuàng)新的市場高度,多年以來致力于發(fā)展富有創(chuàng)新價值理念的產(chǎn)品標(biāo)準(zhǔn),在浙江省等地區(qū)的數(shù)碼、電腦中始終保持良好的商業(yè)口碑,成績讓我們喜悅,但不會讓我們止步,殘酷的市場磨煉了我們堅強不屈的意志,和諧溫馨的工作環(huán)境,富有營養(yǎng)的公司土壤滋養(yǎng)著我們不斷開拓創(chuàng)新,勇于進取的無限潛力,賦悅科技供應(yīng)攜手大家一起走向共同輝煌的未來,回首過去,我們不會因為取得了一點點成績而沾沾自喜,相反的是面對競爭越來越激烈的市場氛圍,我們更要明確自己的不足,做好迎接新挑戰(zhàn)的準(zhǔn)備,要不畏困難,激流勇進,以一個更嶄新的精神面貌迎接大家,共同走向輝煌回來!
- 高新區(qū)中國eCTD歡迎選購 2025-05-14
- 靜安區(qū)生物制品eCTD使用 2025-05-14
- 蕪湖新藥eCTD是什么 2025-05-14
- 吳江區(qū)賦悅科技eCTD供應(yīng)商 2025-05-14
- 南京生物制品eCTD注冊系統(tǒng) 2025-05-14
- 上海化學(xué)藥品eCTD格式 2025-05-09
- 南京電子申報eCTD哪個品牌好 2025-05-09
- 太倉NDAeCTD服務(wù)價格 2025-05-09
- 浦東新區(qū)原料藥eCTD文件如何制作 2025-04-26
- 南京新藥eCTD找哪家 2025-04-26
- 江蘇上下料機器人廠家精選 2025-06-13
- 重慶智能化文件備份-網(wǎng)盤哪家強 2025-06-13
- 廣州高密度膠片掃描儀口碑 2025-06-13
- 陜西稀有蜂蜜哪里有 2025-06-13
- 蘇州游戲開發(fā)怎么設(shè)置 2025-06-13
- 徐州通用設(shè)備管理系統(tǒng)企業(yè) 2025-06-13
- 科技智能營銷檢修 2025-06-13
- 上海綜合的PCBA生產(chǎn)加工哪里有 2025-06-13
- 無錫質(zhì)量共享云桌面軟件服務(wù)至上 2025-06-13
- 奉賢區(qū)常見互聯(lián)網(wǎng)數(shù)據(jù)服務(wù) 2025-06-13