合肥外泌體提取試劑廠家直銷
外泌體是一種存在于細胞外的多囊泡體,可通過細胞內吞泡膜向內凹陷形成多泡內涵體,內涵體與細胞膜融合后釋放其中的小囊泡。外泌體的直徑在40-110nm之間,其中包含RNA、蛋白質、microRNA、DN**段等多種物質,存在于血液、唾液、尿液、腦脊液和母乳等多種體液中。外泌體從發現至今已有30多年的歷史,雖然較初被認為可能是細胞的“垃圾”,所以才被排出來,但是近年來研究表明外泌體具有功能活性并可進行細胞間信息傳遞。如今,研究已經發現外泌體在抗原提呈細胞中呈遞抗原程中、一些病癥細胞發生的發展、神經細胞信號轉導過程中都發揮著重要作用。專利申請利用分離培養人尿液來源細胞并收集培養基來進行體外培養。外泌體(Exosome)是從體液(尿液、血液、唾液、腹水、胸腹水等)和細胞液中快速提取的。合肥外泌體提取試劑廠家直銷
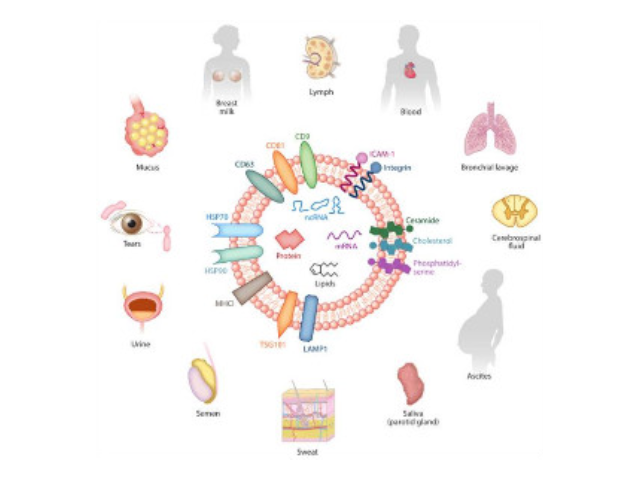
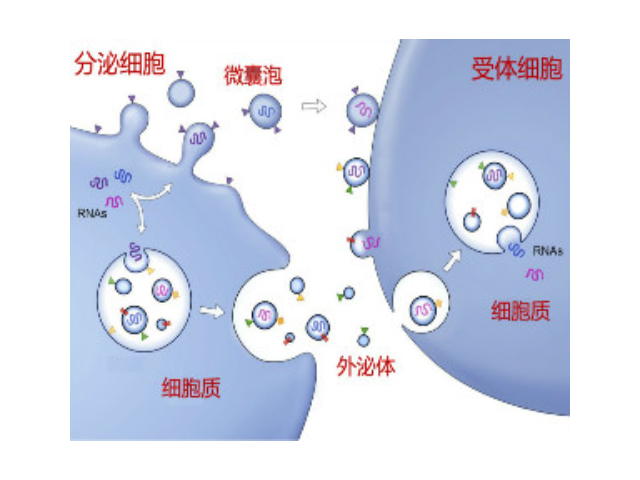
外泌體的形成與鑒定:首先,細胞膜內陷形成一個杯狀結構,包括細胞表面蛋白和與細胞外環境相關的可溶性蛋白,導致早期胞內體(early-sortingendosome,ESE)的從頭形成,或者是杯狀結構直接和已經存在的ESEs融合;trans-高爾基體和內質網也能協助形成ESEs。ESE成熟后形成晚期胞內體(late-sortingendosomes,LSEs),較終形成MVBs(也稱為多囊內小體)。MVBs是通過endosome限制膜向內凹(即質膜雙凹)形成的,這一過程導致MVBs含有多個ILVs。MVB可以與溶酶體或自噬體融合,較終降解或與質膜融合釋放作為外泌體的ILVs。外泌體表面蛋白包括四聚體蛋白、整合蛋白、免疫調節蛋白等。外泌體可以包含不同類型的細胞表面蛋白、細胞內蛋白、RNA、DNA、氨基酸和代謝物。使用可截留100KD分子量的膜,通過離心截留上清中的外泌體,截留完成后。合肥外泌體提取試劑廠家直銷近年來,隨著人們對外泌體的研究和認識加深。

外泌體(Exosomes)是細胞分泌到胞外的一種囊泡(ExtracellularVesicles,EVs),其大小為30-150nm,具有雙層膜結構和茶托狀形態,含有豐富的內含物(包括核酸、蛋白和脂質等),參與細胞間的分子傳遞。外泌體普遍存在于細胞培養上清以及各種體液中,包括血液、唾液、尿液、乳汁等,同時也存在于組織樣本中,如腦組織、肌肉組織、脂肪組織等。腦組織分離方法簡述:將腦組織剪成薄片,放入離心管中加上消化液進行消化,經水浴、反復輕輕上下顛倒,再用移液間斷緩慢吹吸至消化結束。隨后加入培養基于消化液中,混勻,置于冰上。再進行一系列的差速超速離心過程,包括除雜、濾膜過濾、超離等。較后用PBS重懸外泌體,用重懸后的外泌體進行下面的透射電鏡(TEM)、納米粒徑追蹤分子(NTA)和markerWB鑒定。來源于細胞內溶酶體微粒內陷形成的多囊泡體,經多囊泡體外膜與細胞膜融合后釋放到胞外基質中
外泌體的提取、分離方法:梯度密度離心法。研究發現,外泌體的密度在1.1~1.19kg·L-1之間,因此,可以采用密度梯度離心法來分離外泌體。該方法是將超速離心結合蔗糖密度梯度或蔗糖墊結合,原理是先除去非囊泡物質,再通過梯度密度濃縮提取外泌體,該方法可以得到相對較為純凈的外泌體。傳統的梯度密度方法通常需要離心16h,但是2012年,研究者[15]使用了62~90h才分離出某些確切囊泡,因此,該方法可能不足以沉淀所有的外泌體。如果離心時間不充足,污染物質可能和外泌體保持在相同的密度層,特別是這個密度范圍又比較寬。在超速離心力作用下,使蔗糖溶液形成從低到高連續分布的密度階層,是一種區帶分離法。
有研究發現,NSCLC患者肺組織外泌體表面EGFR免疫染色呈陽性的占80%,而慢性肺炎組織的外泌體EGFR呈陽性的只占2%,因而認為外泌體的EGFR蛋白可以用作NSCLC與慢性肺炎鑒別診斷的生物標志物。Park等通過Sys-BodyFlu-id數據庫分析發現153種特異性胸腔積液外泌體蛋白質,進一步的Westernblotting分析顯示多種特異性胸腔積液外泌體蛋白參與EGFR信號傳導途徑以促進一些病癥的發生的發展,因此外泌體蛋白可能作為肺病診斷篩查的生物學標記物。外泌體相關蛋白質與肺病的診斷:近年來眾多文獻報道,肺病細胞分泌的外泌體中富含多種蛋白質并促進肺病的發生的發展,是早期診斷肺病的有效途徑。專利申請利用分離培養人尿液來源細胞并收集培養基來進行體外培養。合肥外泌體提取試劑廠家直銷
可以使用NanoSight?或電子顯微鏡分析純化的外泌體,以評估近似外泌體大小范圍和濃度。合肥外泌體提取試劑廠家直銷
外泌體(exosome)是所有細胞釋放出的細菌大小的顆粒。它們天然地存在于血液中。根據來自美國德州大學MD安德森一些疾病中心的一項新的研究,對外泌體進行基因操縱可能提供一種新的胰腺病治病方法。論文通信作者為德州大學MD安德森一些疾病中心一些疾病生物學系研究員RaghuKalluri博士。在這項新的研究中,經過基因修飾的外泌體(被稱作iExosome)能夠運送特異性地靶向KRAS突變基因的小RNA分子,從而導致胰腺病模式小鼠病情緩解,增加它們的總存活率。這些研究人員采用了一種被稱作RNA干擾(RNAi)的靶向方法:利用這些天然的納米顆粒(即外泌體)運送小干擾RNA(siRNA)或短發夾RNA(shRNA)分子來靶向胰腺病細胞中的KRAS突變基因,從而影響多種胰腺病模型的一些病癥負荷和存活。他們證實外泌體能夠作為一種高效的RNAi載體發揮作用,這是因為這些納米大小的囊泡(即外泌體)輕松地在體內遷移和進入靶細胞(包括病細胞)中。合肥外泌體提取試劑廠家直銷
- 無錫正規外泌體提取試劑廠家批發價 2025-07-08
- 寧波外泌體提取試劑供應商 2025-07-08
- 徐州外泌體提取試劑哪里買 2025-07-08
- 溫州濟南細胞外基質膠 2025-07-08
- 重慶正規外泌體提取試劑價格 2025-07-08
- 上海正規細胞外基質膠產品介紹 2025-07-08
- 天津正規細胞外基質膠直銷廠家 2025-07-08
- 武漢細胞外基質膠哪里買 2025-07-08
- 深圳正規細胞外基質膠價格 2025-07-08
- 濟南正規外泌體提取試劑廠家供應 2025-07-08
- 貴州高效選礦設備耐磨保護哪里買 2025-07-09
- 廣東化學高錳酸鉀量大從優 2025-07-09
- 水性防腐涂料哪種好 2025-07-09
- 遼寧先尼科顏料橙73 2025-07-09
- 河南什么是ulc銷售價格 2025-07-09
- 北京正規外泌體提取試劑供應商 2025-07-09
- 常州加工切削液生產 2025-07-09
- 廣東LOCA-低釋放成膜助劑 2025-07-09
- 中山錫煉切削液研發 2025-07-09
- 山東嬰幼兒PS磷脂酰絲氨酸輔助食品 2025-07-08